Calendrier scientifique – Octobre 2024
Surveillance du DAPT par ATL
Comment utiliser l’ATL (agrégométrie par transmission lumineuse) pour surveiller efficacement le DAPT (double traitement antiplaquettaire) ?
Déterminer le TP exprimé en INR
Determining the PT in INR
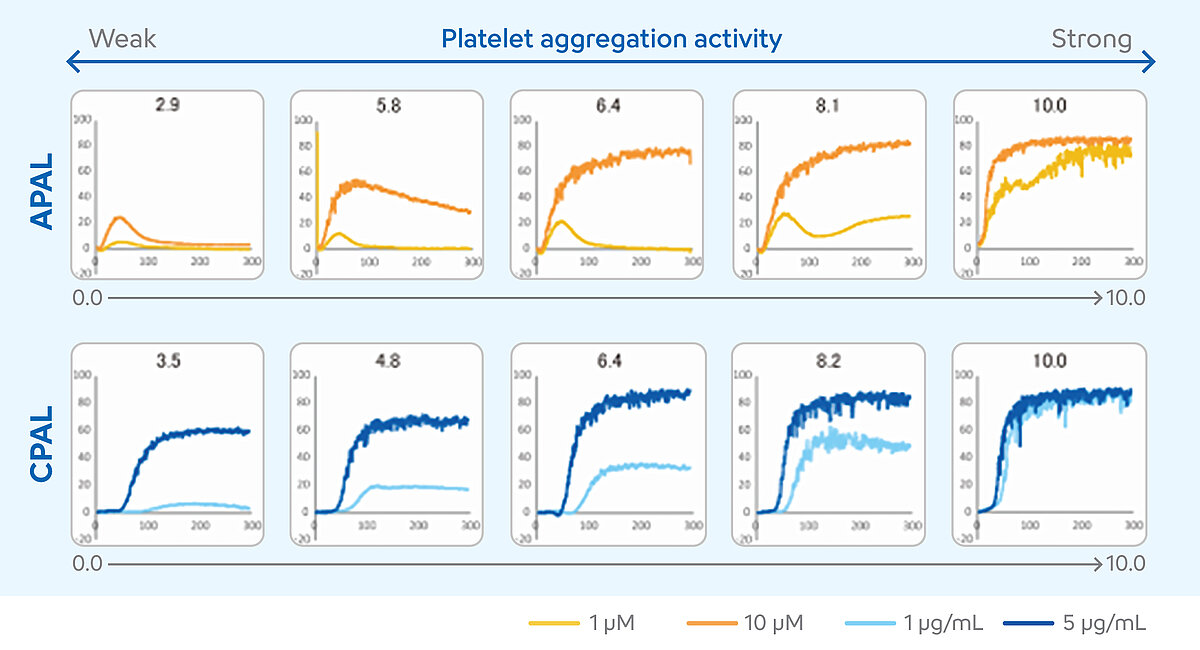
Déterminer les scores APAL et CPAL
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Contexte scientifique
De nos jours, il existe de nombreux outils permettant d’évaluer la fonction plaquettaire. La méthode la plus connue et la plus largement utilisée est l’agrégométrie par transmission lumineuse (ATL) décrite par Born. Cette méthode de mesure a été mise au point en 1963 et représente la référence absolue pour les recherches sur les troubles héréditaires de la fonction plaquettaire. [1, 2] La mesure repose sur une modification de la transmission de la lumière à travers le plasma riche en plaquettes, cette modification étant due à l’activation et à l’agrégation des plaquettes après l’ajout d’un agoniste plaquettaire. [1] Bien que les directives restreignent l’utilisation de l’ATL à des fins de recherche uniquement, la méthode peut également être utilisée pour surveiller le traitement antiplaquettaire. [3]
Le double traitement antiplaquettaire par le clopidogrel ou un autre inhibiteur du récepteur P2Y12 et l’aspirine s’est révélé être une stratégie thérapeutique efficace et recommandée par les directives chez les patients atteints d’une maladie cardiovasculaire. On sait que l’effet pharmacologique des médicaments antiagrégants plaquettaires varie d’une personne à l’autre. Il a été rapporté que de nombreuses personnes ne répondent pas au clopidogrel en raison de polymorphismes du gène CYP2C19. [4–6] L’effet antiplaquettaire de l’aspirine est réduit chez les patients présentant une « résistance à l’aspirine » causée par des polymorphismes simples de nucléotide (SNP) qui affectent la cyclo-oxygénase COX-1 et par conséquent la fonction plaquettaire, l’inflammation et le syndrome métabolique. [7–9]
Ces dernières années, les analyseurs de coagulation entièrement automatisés de la série CS (sauf CS-1600) et de la série CN (tous produits par Sysmex Corporation, Kobe, Japon), qui réduisent l’intervention manuelle de l’opérateur et améliorent ainsi fortement la précision et la répétabilité des résultats, ont permis de standardiser davantage l’ATL.
Tableau 1 Comparaison de l’ATL effectuée par un analyseur semi-automatisé et les analyseurs des séries CS et CN
| Semi-automatisé | Étape de l’analyse | Série CN et série CS |
| Manuelle | Prélèvement et préparation d’un échantillon de sang | Manuelle |
| Manuelle | Préparation de la cuvette à agitateur | Minimisée |
| Manuelle | Distribution de l’échantillon | Automatisée |
| Manuelle | Dilution de l’agoniste | Automatisée* |
| Manuelle | Distribution de l’agoniste | Automatisée |
| Automatisée | Détection de l’agrégation | Automatisée |
| Automatisée | Sortie du résultat | Automatisée |
*Série CN uniquement
L’interprétation des résultats des mesures de l’ATL requiert un haut degré d’expertise. Il est essentiel de tenir compte des différents résultats numériques et de l’évolution de la courbe lors de l’évaluation de chaque cas particulier. Au cours des dernières années, ces conditions ont limité l’utilisation de l’ATL pour la surveillance du double traitement antiplaquettaire (DAPT). La méthode des agonistes à deux concentrations a donc été mise au point pour les analyseurs des séries CS et CN afin de surmonter ce problème et de faciliter l’interprétation des résultats. [10] Dans cette méthode, les mesures des échantillons de patients sont effectuées au moyen de deux concentrations d’agonistes différents, l’un étant sensible à l’aspirine et l’autre à un inhibiteur du récepteur P2Y12. Les résultats des deux concentrations sont exprimés sous forme d’un score correspondant au niveau de l’agrégation plaquettaire (PAL). Ce score peut être utilisé pour estimer si l’efficacité du DAPT est suffisante ou si le patient nécessite un ajustement de son traitement. PAL est une fonction supplémentaire de l’analyseur et utilise deux agonistes plaquettaires, à savoir l’ADP comme agoniste sensible à l’inhibiteur du P2Y12 et le collagène comme agoniste sensible à l’aspirine. Le niveau de l’agrégation plaquettaire induite par l’ADP (APAL) est calculé à partir des mesures effectuées aux concentrations de 1 µM et de 10 µM, et le niveau de l’agrégation plaquettaire induite par le collagène (CPAL) est calculé à partir des mesures effectuées aux concentrations de 1 µg/mL et de 5 µg/mL. Le calcul des scores APAL et CPAL est réalisé à l’aide de l’aire sous la courbe (ASC). [11-13]
Les scores peuvent aller de 0 à 10. Des scores plus élevés de PAL indiquent des niveaux d’agrégation plaquettaire plus importants, suggérant une réponse insuffisante ou l’absence de réponse au DAPT, tandis que des scores PAL plus faibles indiquent des niveaux d’agrégation plaquettaire réduits, suggérant une réponse adéquate au DAPT. [14]
Les études sur les scores PAL obtenus sur les analyseurs des séries CS et CN ont montré une imprécision inférieure à 5 % pour les échantillons inoculés avec de l’aspirine (CPAL) ou avec le cangrélor, un inhibiteur de P2Y12 (APAL) sur un analyseur de série CN. Sur l’analyseur CS-5100, l’imprécision était inférieure à 10 % pour les échantillons inoculés avec le cangrélor (APAL) et inférieure à 5 % pour les échantillons inoculés avec l’aspirine (CPAL). La corrélation entre les résultats de PAL produits par les deux séries d’analyseurs est excellente, comme le montre le Tableau 2. [14, 15]
Tableau 2 Corrélation entre les analyseurs CN-6000 et CS-5100
| AGONISTE | CONCENTRATION | N | COEFFICIENT R | |
| ADP | 1 µM | 85 | 0,988 | y = 1,00x + 3,85 |
| 10 µM | 85 | 0,955 | y = 0,89x + 11,44 | |
| Score APAL | 85 | 0,971 | y = 0,91x + 0,94 | |
| COLLAGENE | 1 µg/mL | 82 | 0,996 | y = 1,02x - 0,83 |
| 5 µg/mL | 82 | 0,972 | y = 0,99x + 0,66 | |
| Score CPAL | 82 | 0,994 | y = 1,00x - 0,08 |
D’autres études ont démontré une sensibilité du système PAL supérieure à celle d’une utilisation conventionnelle de l’ATL sans système de score. Il a été établi que le score PAL réduisait la variabilité chez un même sujet et se révélait plus fiable pour mesurer l’efficacité des médicaments antiagrégants plaquettaires comparativement au taux d’agrégation plaquettaire maximal exprimé en pourcentage mesuré avec une seule concentration d’agoniste. [16]
D’autres recherches sont actuellement en cours afin de définir des valeurs seuils pour la surveillance du traitement antiplaquettaire à l’aide du score PAL dont, dans l’idéal, l’utilisation permettra de diminuer sensiblement la récidive des événements thrombotiques pendant le traitement.
Références
[1] Born GV. (1962): Aggregation of blood platelets by adenosine diphosphate and its reversal. Nature. 194: 927–929.
[2] Kang J, Park KW, Palmerini T, et al. (2019): Racial Differences in Ischaemia/Bleeding Risk Trade-Off during Anti-Platelet Therapy: Individual Patient Level Landmark Meta-Analysis from Seven RCTs. Thromb Haemost. 119 (1): 149–162.
[3] Cattaneo M, Cerletti C, Harrison P, Hayward CPM, Kenny D, Nugent D, Nurden P, Rao AK, Schmaier AH, Watson SP, Lussana F, Pugliano MT, Michelson AD. (2013): Recommendations for the standardization of light transmission aggregometry: a consensus of the working party from the platelet physiology subcommittee of SSC/ISTH. J Thromb Haemost; 11:1183–1189.
[4] Cattaneo M. (2010): New P2Y(12) inhibitors. Circulation. 121 (1): 171–179.
[5] Bonello L, Tantry US, Marcucci R, et al. (2010): Consensus and future directions on the definition of high on-treatment platelet reactivity to adenosine diphosphate. J Am Coll Cardiol. 56 (12): 919–933.
[6] Tantry US, Bonello L, Aradi D, et al. (2013): Consensus and update on the definition of on-treatment platelet reactivity to adenosine diphosphate associated with ischemia and bleeding. J Am Coll Cardiol. 62 (24): 2261–2273.
[7] Colantonio LD, Gamboa CM, Kleindorfer DO, et al. (2016): Stroke symptoms and risk for incident coronary heart disease in the REasons for Geographic And Racial Differences in Stroke (REGARDS) study. Int J Cardiol. 220: 122–128.
[8] Cattaneo M. (2007): Resistance to antiplatelet drugs: molecular mechanisms and laboratory detection. J Thromb Haemost. 5, Suppl 1: 230–237.
[9] Cattaneo M. (2004): Aspirin and clopidogrel: efficacy, safety, and the issue of drug resistance. Arterioscler Thromb Vasc Biol. 24 (11): 1980–1987.
[10] Matsuo T, Ohki Y. (1977): Classification of platelet aggregation patterns with two ADP solutions (the double-ADP method) and its clinical application to diabetes mellitus. Thromb Res. 11 (4): 453– 461.
[11] Sakayori T, Watanabe Y, Kitano K, et al. (2019): Evaluating the Utility of a Novel Research Use Index in Platelet Aggregation Analysis Featured in an Automated Blood Coagulation Analyzer to Confirm the Effect of Antiplatelet Drugs. Sysmex J Int. 2019; 29 (1): 39–47.
[12] Omori Y, Ishida H, Sakayori T, et al. (2019): Evaluation of Fully Automated Blood Coagulation Analyzer Equipped with a Novel Analysis Method – Antiplatelet Responsive Index –. Rinsho Byori. 67 (3): 205–211.
[13] Sadakata T, Sakayori T, Watanabe Y, et al. (2018): Basic Evaluation of PAL Which is a Research Use Index for Confirming the Effect of Antiplatelet Drugs Installed in the CS Series and Comparison Study with the Index Installed in Existing Instrument. Sysmex J. 2018; 19 (2): 1–10.
[14] Sakayori T, et al. (2024): Analytical Evaluation of Platelet Aggregation Level on a Fully Automated Coagulation Analyzer CN-6000, and a Case Study of an Initial Absorbance of Platelet-rich Plasma. Sysmex Journal International Volume 34 No.1. Published 12 June 2024.
[15] Shimizu M, et al. (2019): Evaluation of a new analysis index of platelet aggregation test using CS-5100 with G-Type on a PRP313M. Japanese Journal of Medical Technology, Volume 68, Issue 3, Pages 501–506.
[16] Lecchi A, Capecchi M, Padovan L, Artoni A, Arai N, Shinohara S, La Marca S, Peyvandi F. (2024): Evaluation of an automated platelet aggregation method for detection of congenital or acquired platelet function defects. Blood Transfus. 22(4):350–359.